Nature Medicine:783名患者的10年随访——CAR-T疗法的安全性与长期效果全解析
来源:生物探索 2025-01-25 13:52
工程化T细胞疗法,尤其是CAR-T细胞治疗,已成为医学领域的一项革命性进展。其在攻克血液恶性肿瘤中的成功应用,重新定义了癌症治疗的可能性。
近年来,基因疗法和细胞疗法在医学领域的突破性进展为癌症、HIV感染以及遗传疾病等重大健康挑战带来了全新的治疗希望。通过利用慢病毒(lentiviral)或伽马逆转录病毒(gammaretroviral)载体,将工程化的基因导入患者的T细胞,研究人员成功开发出了如嵌合抗原受体T细胞(CAR-T)疗法等创新技术。这些疗法展现出了显著的治疗潜力,特别是在攻克血液恶性肿瘤和难治性感染方面。然而,这些疗法的长期安全性问题仍是研究人员高度关注的焦点。载体整合可能引发插入性致癌、免疫并发症,甚至可能导致不可预见的疾病进展,这些风险引发了公众与医疗界的广泛讨论。
1月20日Nature Medicine的研究报道“Long-term safety of lentiviral or gammaretroviral gene-modified T cell therapies”,正是在这一背景下展开,旨在对783名接受过基因改造T细胞治疗的患者进行深入分析,探索随访数据中的安全性信号。研究聚焦于治疗后可能出现的次生恶性肿瘤(secondary primary malignancies, SPMs)、基因载体插入的潜在致病性以及相关不良事件(PDAEs)的发生情况。通过对大量样本的纵向基因整合位点追踪和详细的数据分析,研究团队不仅发现了次生恶性肿瘤发生的具体风险,还揭示了基因整合在T细胞克隆扩增及其持久性中的作用。这些发现为优化CAR-T疗法的安全性提供了宝贵依据,也进一步推动了基因与细胞疗法在临床中的应用。

基因疗法的崛起:从概念到临床
基因疗法和细胞疗法代表了现代医学的一场革命性变革,通过修饰人体细胞中的基因来治疗或缓解多种复杂疾病。这种方法能够突破传统药物的局限性,直接针对疾病的分子基础实施干预。近年来,这些疗法在攻克癌症、遗传病以及HIV感染等领域展现出了广阔的应用前景。
在基因疗法的探索过程中,病毒载体成为一种关键工具。这些载体可以将特定的基因片段安全、高效地送入患者体内的目标细胞中。其中,慢病毒(lentiviral)和伽马逆转录病毒(gammaretroviral)载体因其稳定的基因整合能力和相对较低的免疫原性,成为工程化T细胞疗法的核心技术。这些载体的出现,使研究人员能够有效改造患者的T细胞,从而显著增强免疫系统的抗病能力。
CAR-T细胞疗法(Chimeric Antigen Receptor T-cell Therapy,嵌合抗原受体T细胞疗法)是基因疗法的一个重要分支。它通过基因工程技术改造患者自身的T细胞,使其表达嵌合抗原受体,能够精准识别并攻击癌细胞或感染细胞。这一疗法最早应用于血液恶性肿瘤的治疗,如B细胞淋巴瘤和急性淋巴细胞白血病(ALL),在临床中取得了显著的成功。例如,CD19导向的CAR-T疗法使许多对传统治疗无效的患者达到了长期缓解。
该研究显示,在多项临床试验中,CAR-T疗法在治疗血液恶性肿瘤和HIV感染时表现出了强大的效果。在783名患者中,有630例患者接受了针对血液恶性肿瘤的治疗,96例针对实体肿瘤,57例针对HIV感染。研究发现,尽管这些患者中很多已经接受过多次化疗或放疗,且病情复杂,CAR-T疗法依然展现了令人振奋的治疗潜力。
T细胞疗法的核心:技术与潜在风险
T细胞疗法的核心在于利用基因工程技术,将患者自身的免疫细胞进行改造,从而使其能够更加精准地识别和攻击病变细胞。在这一过程中,研究人员通常会先从患者体内提取T细胞,通过病毒载体将特定的基因导入这些细胞中,再将改造后的T细胞回输至患者体内。这一过程的关键步骤包括:
T细胞分离:通过外周血采集患者的免疫细胞。
基因转导:利用慢病毒或伽马逆转录病毒载体,将编码嵌合抗原受体(CAR)或T细胞受体(TCR)的基因导入细胞中。
细胞扩增:在实验室条件下,对经过基因改造的T细胞进行大规模扩增,以确保足够的治疗剂量。
回输患者:最终将这些工程化的T细胞输回患者体内,让它们针对肿瘤细胞或感染细胞发挥免疫作用。
这种“量身定制”的治疗策略,使T细胞疗法在血液恶性肿瘤和HIV感染等领域展现出强大潜力,同时也为其他复杂疾病的治疗提供了新的思路。
病毒载体的特性及潜在风险
病毒载体是T细胞疗法的重要工具,其特性直接影响疗法的安全性和有效性。慢病毒载体因其能够将基因稳定整合至宿主细胞的基因组中,确保长效表达,而被广泛应用;伽马逆转录病毒载体虽然在整合效率上表现较高,但整合的随机性可能带来更高的安全性风险。两种载体的共同问题在于整合位点的不确定性,这可能导致重要基因的功能紊乱。
研究指出,病毒载体的基因整合可能触发插入性致癌(insertional oncogenesis)。早期基因疗法试验中因整合导致肿瘤抑制基因(如LMO2)的失活而引发白血病的案例,至今仍提醒研究人员慎重选择整合位点。在最新的临床试验数据中,尽管整合相关的不良事件减少,但仍需对T细胞克隆扩增和长期稳定性进行持续监控。
随访数据揭示,虽然载体整合并未明显增加次生恶性肿瘤(SPMs)的发生率,但研究人员注意到,某些患者的克隆扩增具有潜在风险。这一发现表明,尽管目前的T细胞疗法整体安全性较高,但仍需通过更精确的载体设计进一步降低风险。
长期安全性的全面评估
为全面评估工程化T细胞疗法的长期安全性,该研究采用了多中心设计,覆盖来自38项临床试验的783名患者。这些试验分布于多家权威医疗机构,涉及多种治疗方案和目标疾病,使研究具有高度的代表性和广泛性。研究设计的核心目标是通过长期随访监控次生恶性肿瘤(SPMs)、不良事件(PDAEs)及基因载体整合的潜在风险,从而为疗法的优化提供数据支持。患者的治疗过程、基因整合数据以及免疫反应情况均被纳入标准化的监测体系,通过定期采集外周血样本和临床数据,实现了多维度的动态追踪。
783名患者构成了研究的核心数据来源,涵盖了多种疾病类型和治疗背景。具体分布如下:
血液恶性肿瘤:患者人数最多,达630例,包括B细胞非霍奇金淋巴瘤、急性淋巴细胞白血病等。
实体肿瘤:96例患者接受了针对实体肿瘤的CAR-T疗法,这部分数据为探讨疗法在非血液肿瘤中的应用提供了重要信息。
HIV感染:57例患者的治疗目标是清除HIV感染细胞,这表明基因疗法的潜力不仅限于肿瘤领域。
患者的随访时间分布广泛,覆盖长达2200病患/年,最短随访时间为1年,最长超过10年。这种长时间跨度的数据使研究能够捕捉到长期潜在的不良反应,特别是次生恶性肿瘤的发生模式和风险因素。
数据来源包括:
整合位点分析:对患者的T细胞样本进行高通量测序,追踪病毒载体的基因整合位点。研究发现,在超过3000万个整合位点中,存在部分位点与肿瘤抑制基因重叠,但并未观察到显著的致癌信号。
克隆扩增监控:通过定期采样分析T细胞的克隆扩增情况,发现大多数克隆具有较高的稳定性,仅少数患者表现出异常扩增。
不良事件记录:研究团队对每例患者的不良事件进行了详细记录,特别关注细胞因子释放综合征(CRS)和免疫抑制相关感染。数据显示,严重CRS的发生率较低,并能够通过常规医疗干预控制。
不良事件与次生恶性肿瘤
不良事件(PDAEs)
细胞因子释放综合征(CRS):作为CAR-T疗法最常见的副作用,CRS发生率为18.6%。其中,轻度(1-2级)CRS占绝大多数,仅少数患者出现3级或更高的严重反应。研究指出,这些反应多发生在治疗后1-2周内,表现为发热、低血压和器官功能紊乱。值得注意的是,通过IL-6抑制剂(如托珠单抗)等干预措施,严重CRS病例得到了有效控制。
神经毒性:部分患者出现了神经系统不良反应,包括头痛、意识混乱和癫痫发作。发生率为7.2%,大部分为可逆性事件,且通过支持性治疗可改善。
感染相关事件免疫系统的暂时抑制使患者对感染的易感性增加,尤其是在治疗后早期阶段。数据显示,14.3%的患者出现了感染事件,包括细菌性和病毒性感染。对于严重感染病例,研究团队采取了抗感染药物治疗,患者的恢复率较高。
次生恶性肿瘤(SPMs)
次生恶性肿瘤(Secondary Primary Malignancies, SPMs)的发生是T细胞疗法长期安全性的重要关注点。该研究中,共有2.3%的患者被诊断为次生恶性肿瘤,主要类型包括白血病、淋巴瘤和实体瘤。
白血病和淋巴瘤是次生恶性肿瘤中最常见的类型,占比约为60%。这部分患者通常有恶性肿瘤的病史或高危遗传背景。虽然部分病例可能与病毒载体的基因整合有关,但研究未发现明确的因果关系。
剩余的次生恶性肿瘤病例为实体瘤,主要集中在肝脏、胃和肺等部位。这些病例的发生可能与患者的基础疾病或长期免疫抑制状态相关。研究团队通过进一步分析整合位点数据,发现未观察到与致癌基因的直接关联。
次生恶性肿瘤的发生多集中在治疗后1-3年内,这一时间段是载体整合可能引发风险的关键窗口期。随访数据显示,随着时间延长,新发SPMs的风险逐渐降低,提示载体整合在长期效应中的影响可能较小。
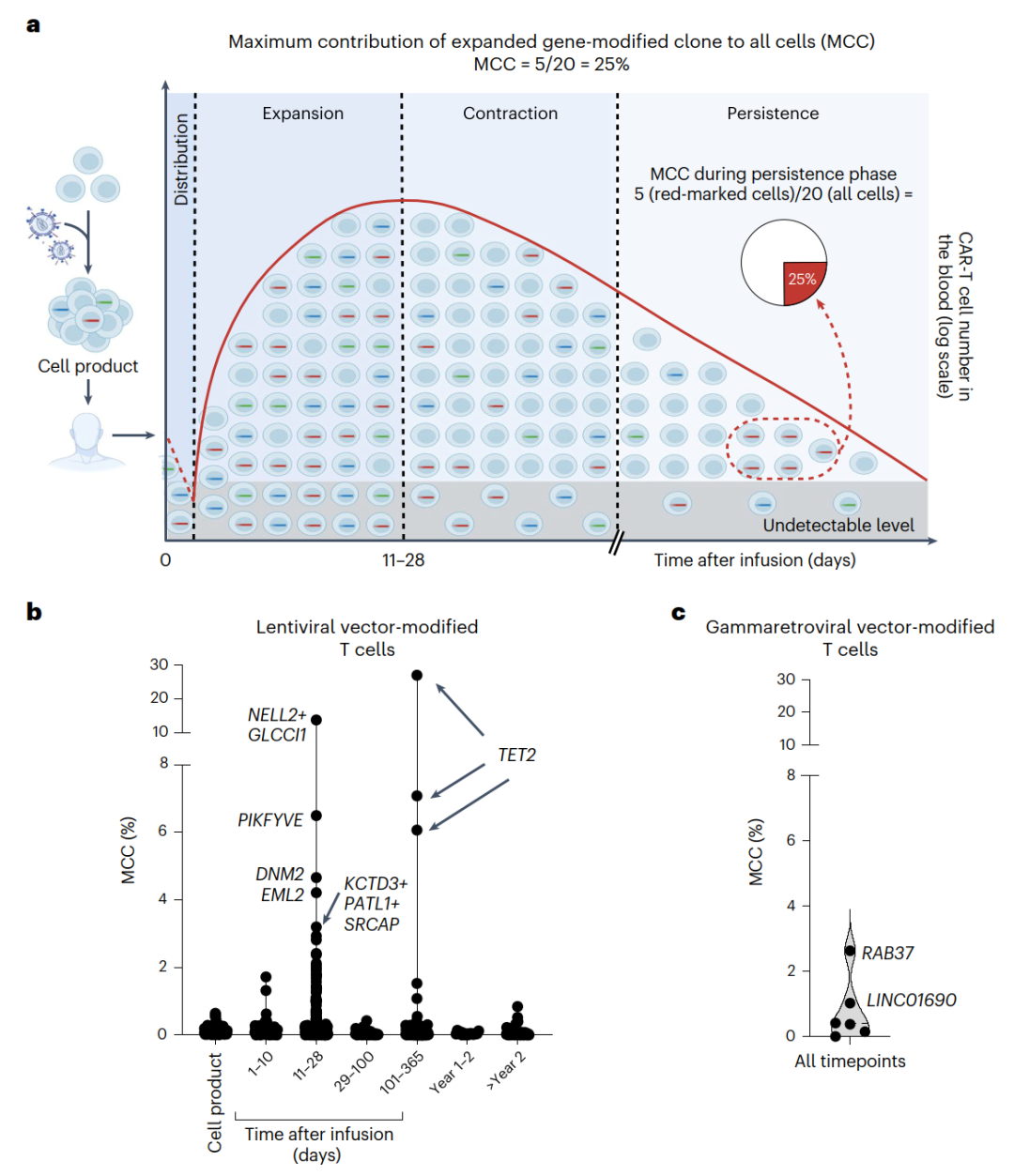
对两种病毒载体转导的CAR-T细胞克隆扩增和贡献的比较(Credit: Nature Medicine)
(a) 图示:最大贡献率(MCC)的测量方法
展示了在CAR-T细胞治疗的持续阶段,如何测量一个基因修饰T细胞克隆对所有采样细胞的最大贡献率(Maximum Contribution of a Clone, MCC)。这一指标用于评估基因修饰T细胞克隆在患者体内扩增和长期存活的能力。该示意图明确了MCC的定义与测量的时间点,直观地说明了在治疗后期(持续阶段)的克隆贡献动态变化过程。
(b) 慢病毒载体转导的T细胞MCC分析
慢病毒载体(lentiviral vector)转导T细胞的MCC随时间的变化。横轴表示治疗后不同的时间间隔,纵轴显示MCC值。数据表明,在CAR-T细胞治疗后早期,某些克隆可能快速扩增并达到较高的MCC值,但随着时间推移,这些克隆的贡献趋于平稳,表明克隆扩增在长期内具有一定的稳定性。整体趋势显示,慢病毒载体转导的克隆扩增和贡献在治疗后的不同时间点表现出相对较低的波动性。
(c) 伽马逆转录病毒载体转导的T细胞MCC分析
伽马逆转录病毒(gammaretroviral vector)转导T细胞的MCC随时间的变化情况。伽马逆转录病毒转导的T细胞克隆在治疗后早期阶段也表现出显著扩增,但其MCC值在长期中显示出更大的波动性,某些克隆的贡献可能在后期显著降低。与慢病毒载体相比,伽马逆转录病毒载体的克隆扩增趋势更加不稳定,这可能与其整合位点的随机性及治疗策略相关。
载体整合与T细胞表现:科学新发现
基因载体插入位点的纵向追踪与分析
数据显示,研究团队通过高通量测序技术,对超过3000万个整合位点进行了详细分析。结果表明,这些整合位点分布在全基因组范围内,但存在一定的偏好性,尤其倾向于基因活跃区域(如启动子附近)。这一现象可能是由于病毒载体的特性使其更容易插入到转录活跃的基因区域。虽然部分整合位点与已知肿瘤抑制基因(如TP53、RB1)存在重叠,但进一步分析显示,大多数插入位点并未引发基因功能紊乱。
纵向追踪还揭示了整合位点的动态变化。部分克隆在早期显著扩增,随后趋于稳定,而另一些克隆则在长期随访中逐渐消失。这一发现表明,尽管基因载体整合具有潜在风险,但其对患者基因组的整体影响可能是有限的。
克隆扩增与长效T细胞存活的相关机制
工程化T细胞的长效存活是确保疗效的关键因素,而克隆扩增则是其存活和功能的核心指标之一。研究发现,在接受治疗的患者中,T细胞克隆的扩增存在显著个体差异,但总体表现出较高的稳定性。
数据显示,在治疗后早期(1-3个月),大多数患者的T细胞克隆呈现快速扩增的趋势。这一阶段的扩增可能是由于CAR-T细胞成功识别并杀伤目标细胞所引发的免疫反应。随着时间的推移,这些克隆逐渐趋于平稳,部分克隆甚至表现出持续的低水平表达,表明其具有长期存活的潜力。
影响克隆扩增的因素
整合位点的选择:研究发现,整合位点位于基因表达活跃区域的T细胞克隆往往更容易扩增并长期存活。
治疗背景:疾病类型和患者的免疫状态也显著影响克隆扩增模式。例如,在血液恶性肿瘤患者中,扩增的克隆数通常较高,这可能与肿瘤负荷相关。
克隆扩增的长期稳定性直接决定了疗法的持久疗效。研究指出,部分患者在治疗后多年仍能检测到功能活跃的CAR-T细胞,这一现象证明了基因疗法在提供持久免疫监控方面的潜力。
发现与肿瘤抑制基因相关的整合位点
虽然大多数载体整合未引发明显的不良后果,但少数整合位点与肿瘤抑制基因重叠引发了研究人员的警惕。例如,在某些病例中,整合位点靠近TP53和RB1基因,理论上可能导致肿瘤抑制功能的失活。然而,数据显示,这些患者的整合事件未表现出直接致癌作用,提示此类整合的实际影响可能受到多因素调控。
进一步分析揭示,肿瘤抑制基因相关的整合位点并非随机分布,而是可能受到病毒载体特性的影响。研究团队通过模型预测,优化载体设计有望进一步降低整合位点的风险。例如,利用靶向特定基因区域的新型载体技术(如CRISPR-Cas9)可以显著减少不良整合的发生率。
治疗的双刃剑:免疫缺陷与并发症
CAR-T细胞疗法通过重塑患者的免疫系统来对抗恶性肿瘤,但这种免疫重构过程并非没有代价。在部分患者中,治疗可能引发一系列免疫抑制现象。研究发现,这种免疫抑制主要表现为两方面:
正常B细胞的耗竭:CAR-T细胞疗法的主要靶点之一是表达CD19抗原的细胞。然而,由于正常B细胞也表达CD19,治疗后患者可能出现显著的B细胞耗竭(B-cell aplasia),导致抗体产生能力下降。这种情况被认为是免疫抑制的重要表现之一,且可能持续多年。
细胞因子释放综合征后的免疫重塑:部分患者在经历严重的细胞因子释放综合征(CRS)后,免疫系统可能需要较长时间恢复。在此期间,患者对感染的抵抗能力显著下降,并可能表现出持续性炎症和免疫功能紊乱。
免疫抑制虽然是CAR-T疗法不可避免的副作用,但它也为感染和次生恶性肿瘤提供了温床。
感染风险增加:在接受CAR-T疗法的患者中,感染的发生率高达14.3%。这些感染通常集中在治疗后3个月内,包括细菌、病毒和真菌感染。特别是在B细胞耗竭的患者中,病毒性肺炎和败血症的风险显著增加。该研究数据还指出,部分患者因免疫球蛋白水平长期低下,需要通过静脉注射免疫球蛋白(IVIG)来预防感染。
次生恶性肿瘤的隐患:免疫抑制不仅使患者更容易受到感染,还可能间接增加肿瘤发生的风险。研究发现,在免疫系统重建缓慢的患者中,肿瘤监控能力可能减弱,从而为肿瘤细胞的复发或新发创造机会。尽管该研究数据显示次生恶性肿瘤的发生率较低(约2.3%),但这一风险在免疫功能严重受损的患者中尤为显著。
工程化T细胞疗法,尤其是CAR-T细胞治疗,已成为医学领域的一项革命性进展。其在攻克血液恶性肿瘤中的成功应用,重新定义了癌症治疗的可能性。然而,随着研究的深入,其安全性和广泛应用的前景也得到了更全面的评估。
从该研究的随访数据来看,尽管次生恶性肿瘤(SPMs)和不良事件(PDAEs)在一定范围内存在,但这些风险是可控的。通过改进载体设计、优化治疗流程以及加强长期监控,研究人员已经显著降低了治疗相关的潜在危害。同时,克隆扩增和载体整合的长期追踪显示,工程化T细胞疗法具有持久的抗肿瘤能力。这一发现不仅验证了疗法的可靠性,还为进一步扩展其适应症提供了理论支持。
更重要的是,这种疗法的潜力不仅限于肿瘤领域。随着基因编辑技术的加入,CAR-T疗法有望应用于实体瘤、免疫系统疾病甚至慢性感染的治疗。这些前景展示了工程化T细胞疗法不仅是当下的突破,更是未来医学的重要支柱。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


